Histaminstoffwechsel bei Gesunden
Seitenübersicht:
Zusammenfassung:
Eigenschaften von Histamin:
Histamin ist ein natürlich vorkommendes biogenes Amin. Dieses recht kleine Molekül ist gut wasserlöslich, aber schlecht fettlöslich.
Biosynthese:
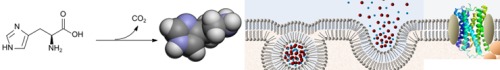
Histamin wird aus der Aminosäure Histidin gebildet. Das dazu befähigte Enzym heisst Histidin-Decarboxylase (HDC).
Vorkommen:
Im tierischen Organismus erfüllt Histamin wichtige Funktionen, ist aber auch bei Bakterien und Pflanzen verbreitet. Es wird als körpereigener Stoff in Mastzellen und anderen spezialisierten Blut- und Gewebezellen gebildet. In hunderten kleinen Bläschen (Vesikel) eingeschlossen wird Histamin hauptsächlich in den Mastzellen gespeichert. In diesen Mastzellen, die als Teil des Immunsystems den Körper bei "Feindkontakt" mittels Ausschüttung von Botenstoffen in Alarmbereitschaft versetzen, steht es bei Bedarf zur sofortigen Freisetzung bereit. Nach der Freisetzung zirkuliert es zwischen den Zellen und im Blut.
Nebst Immunreaktionen gegen Krankheitserreger und Allergene können in geringerem Masse auch weitere physikalische, chemische und psychische Reize die Freisetzung von Histamin und anderen Botenstoffen auslösen. Chemische Auslöser nennen wir Liberatoren.
Histamin kann aber auch in Lebensmitteln als Verderbnisprodukt sowie bei der Gärung und Reifung entstehen. Auch die Darmflora im Verdauungstrakt produziert Histamin. Eine enzymatische Barriere verhindert beim Gesunden, dass dieses von aussen kommende Histamin in den Körper gelangt und dort den Stoffwechsel durcheinander bringt.
Funktionen von Histamin:
Histamin ist an der Regulation unzähliger Stoffwechselvorgänge beteiligt. Seine vermutlich wichtigste Funktion ist es, bei einem Angriff den Körper in einen Ausnahmezustand zu versetzen.
Histamin entfaltet seine Wirkung auf die Zellen einerseits über vier Histaminrezeptoren (H1, H2, H3, H4), die auf der Oberfläche der Zellen sitzen und ein Signal ins Innere der Zelle leiten, wenn ein Histaminmolekül andockt. Andererseits kann Histamin auch durch aktive Transportmechanismen in die Zellen eingeschleust werden und dort Signalproteine verändern (Monoaminylierung), deren länger anhaltende Hormonwirkung aber noch weitgehend unerforscht ist.
Der Histamin-H1-Rezeptor vermittelt die wichtigsten der bekannten allergieartigen Wirkungen des Histamins. Dazu zählen Juckreiz und Schmerz, Entzündungen, Muskelkontraktion in Bronchien und grossen Blutgefässen sowie Erweiterung kleinerer Blutgefässe, Blutdruck, Regulation der Körpertemperatur.
H2-Rezeptoren verstärken die Magensäureproduktion, beschleunigen die Transportbewegungen des Darms (Durchfall) und den Herzschlag.
Über den H3-Rezeptor wird besonders in Nervenzellen die Freisetzung von weiterem Histamin gehemmt und die Ausschüttung weiterer Neurotransmitter wird reguliert.
Über den H4-Rezeptor wird die zielgerichtete Wanderung von Immunzellen hin zur Quelle von Histamin gesteuert. So werden Abwehrzellen zum Entzündungsherd gelockt.
Abbau:
Die Diaminoxidase (DAO) verhindert hauptsächlich im Darm als enzymatische Barriere die Aufnahme des von aussen kommenden Histamins in den Körper.
Die Histamin-N-Methyltransferase (HNMT) sorgt für den Abbau von Histamin im Innern der Zellen.
Ferner kann auch die Monoaminoxidase B (MAO-B) nebst anderen Aminen Histamin abbauen.
Chemische Eigenschaften von Histamin
Histamin (zusammengesetzt aus dem griechischen "histos" = Gewebe und "amin" = stickstoffhaltige Verbindung) ist ein Naturstoff, der im tierischen Organismus wichtige regulatorische und mediatorische Funktionen erfüllt und auch in Bakterien und im Pflanzenreich weit verbreitet ist. Biochemisch gehört Histamin zur Gruppe der biogenen Amine. In reiner Form handelt es sich um einen weissen Feststoff mit einer molaren Masse von 111.15 g/mol. Histamin ist gut löslich in Wasser und Ethanol, jedoch unlöslich in Diethylether, was auf eine schlechte Fettlöslichkeit schliessen lässt.
Summenformel: C5H9N3
Strukturformel: 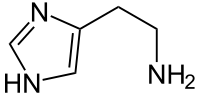
Synonyme: 2-(4-Imidazolyl)-ethylamin
Englisch: histamine
CAS-Nummer: 51-45-6
Biosynthese von Histamin
Histamin wird aus der Aminosäure Histidin gebildet durch Abspaltung von CO2 (=Decarboxylierung). Das dazu befähigte Enzym heisst dem entsprechend Histidin-Decarboxylase (HDC).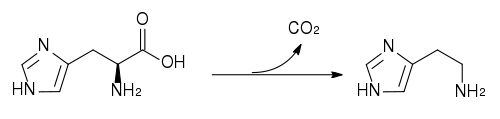
Die Fähigkeit zur Bildung von Histamin (Histaminbiosynthese) ist im Tierreich, im Pflanzenreich und bei Mikroorganismen (Bakterien, Hefen) weit verbreitet.
Vorkommen von Histamin
Endogenes (=körpereigenes) Histamin
Speicherung
Histamin wird als körpereigener Stoff in spezialisierten Blut- und Gewebezellen gebildet und gespeichert. Die Speicherung erfolgt an Heparin gebunden in sogenannten Vesikeln. Vesikel sind kleine, durch eine Membran abgegrenzte Bläschen im Innern der Zellen. In diesen Bläschen eingeschlossen und immobilisiert kann Histamin keinen Schaden anrichten, steht aber bei Bedarf zur sofortigen Freisetzung bereit. Histamin wird insbesondere in folgenden Zelltypen gebildet und gespeichert:
- Mastzellen [Jarisch 2004]
- Basophile Granulozyten [Jarisch 2004; Maintz and Novak 2007]
- Enterochromaffine Zellen [Maintz and Novak 2007]
- Enterochromaffin-ähnliche Zellen [Maintz and Novak 2007]
- Histaminerge Neuronen und andere Nervenzellen, z.B. cerebrovasculäre Endothelzellen [Hough 1999; Maintz and Novak 2007]
- Thrombozyten (Blutplättchen, engl. platelets) [Mannaioni et al. 1993; Masini et al. 1994; Maintz and Novak 2007]
- Neutrophile Granulozyten (weisse Blutkörperchen, engl. neutrophil granulocyte) speichern nicht, sondern produzieren verstärkt Histamin bei Kontakt mit bestimmten Bakterienarten [Xu et al. 2012; Potera 2012]
Die Mastzellen (Mastozyten) dienen der Abwehr von fremden Eindringlingen. Sie sind somit als "Wächter", die bei Gefahr Alarm schlagen, ein wichtiger Teil des Immunsystems. Die Alarmierung anderer Körperzellen erfolgt durch Freisetzung von Histamin und anderen Botenstoffen. Die Mastzellen sind wohl die wichtigsten Histamin speichernden Zellen. Von den Mastzellen weiss man bereits, dass sie Histaminprobleme verursachen können (siehe Seite Histaminose > Ursachen-Überblick). Wie weit die anderen Zelltypen für Histamingeplagte klinisch relevant sein könnten, muss noch geklärt werden.
Freisetzung
Aus den Vesikeln der Mastzellen (und in geringerem Masse auch aus anderen der oben genannten Speicherzellen) können bei Stimulation durch bestimmte chemische und physikalische Reize (Triggerfaktoren) über 60 verschiedene Botenstoffe freigesetzt werden, die man (Mastzell)mediatoren nennt. Histamin ist wohl einer der wichtigsten, aber doch nur einer von vielen Mediatoren. Die Freisetzung dieser Stoffe kann selektiv erfolgen, d.h. abhängig vom Reiz und von Regulationsmechanismen werden nicht immer alle Stoffe gleich stark ausgeschüttet.
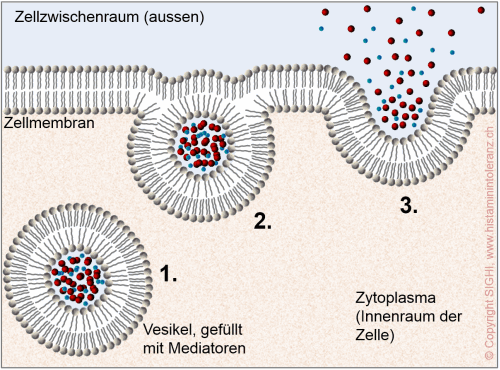
Schematische Zeichnung: Freisetzung von Mediatoren, die in Vesikeln (Bläschen) der Mastzellen eingeschlossenen sind. Sowohl die Vesikel wie auch die Zelle werden durch eine flüssige Membran in Form einer Lipiddoppelschicht begrenzt. Die Membran der im Innern der Zelle liegenden Vesikel verschmilzt mit der Zellmembran und gibt so die darin gespeicherten Stoffe frei. Diesen Vorgang der Ausscheidung der Stoffe aus der Zelle heraus nennt man Exozytose. Der genaue Mechanismus ist noch ungeklärt.
Freigesetztes körpereigenes Histamin zirkuliert im Blut und in der Gewebeflüssigkeit (Interstitialflüssigkeit), welche sich in den Geweben zwischen den Zellen befindet. Seine Aufgabe ist es, andere Zellen in der Nachbarschaft zu alarmieren, indem es an Histaminrezeptoren auf der Oberfläche der Zellen andockt und dadurch ein Signal ins Innere der Zellen leitet. Zum Teil wird es auch aktiv in Zellen eingeschleust und wird dort entweder von der HNMT abgebaut oder es setzt Signalübertragungsketten im Innern der Zellen in Gang. Weitere Details siehe Abschnitt Funktionen von Histamin.
Der stärkste Reiz, der eine schlagartige Freisetzung auslösen kann, sind Antikörper, die mit einem "Fremdkörper" verklumpt sind. Daneben gibt es aber auch chemische und physikalische Reize, welche die Mastzellen zu unspezifischer Freisetzung (d.h. ohne Antigen-Antikörper-vermittelte Immunreaktion) anregen können. Stoffe, die körpereigenes Histamin unspezifisch freisetzen können, nennt man Histaminliberatoren (von lat. liberare = befreien). Sie lösen eine pseudoallergische Reaktion aus (Pseudoallergie).
Die folgende schematische Abbildung zeigt den Unterschied zwischen einer echten allergischen Reaktion und einer Pseudoallergie: [Bildquelle: Wikipedia]
Bei einer echten Allergie (links) wird ein Allergen von den darauf passenden Antikörpern als körperfremder Eindringling erkannt. Wenn dieser Antigen-Antikörper-Komplex an einen entsprechenden Rezeptor auf der Oberfläche einer Mastzelle andockt, löst dies die Freisetzung von Histamin und anderen Mediatoren aus. Sie dienen als Signalüberträger (Botenstoffe), um im Körper eine Abwehrreaktion auszulösen.
Bei einer Pseudoallergie (rechts) ist kein Fremdkörper vorhanden, auf den das Immunsystem reagieren würde. Stattdessen wirkt ein Stoff (Histaminliberator) direkt auf die Mastzellen ein und hat die Eigenschaft, diese zur Histaminfreisetzung zu stimulieren. Es handelt sich nicht um eine Antigen-Antikörper vermittelte Reaktion, verläuft also ohne Beteiligung des Immunsystems. Das Resultat (Histaminausschüttung) ist aber dennoch das selbe. Das Histamin löst die gleichen Symptome aus wie bei einer echten allergischen Reaktion. In der Regel verläuft aber eine pseudoallergische Reaktion weniger heftig als eine allergische Reaktion. Der genaue Auslösemechanismus auf molekularer Ebene ist noch weitgehend unverstanden.
Auf der Seite Therapie > Ernährungsumstellung wird auf die Nahrungsmittel verwiesen, welche solche histaminliberierenden Stoffe enthalten. Auch viele Medikamentenwirkstoffe haben eine stark histaminliberierende Wirkung, so dass in vielen Fällen eine medikamentöse Behandlung die Ursache einer Histaminose ist. Die zu meidenden Wirkstoffe sind auf der Seite Therapie > Medikamente im Abschnitt "unverträgliche Medikamente" aufgelistet.
Detailliertere Informationen zur Histaminfreisetzung durch Mastzellaktivierung finden Sie hier: mastzellaktivierung.info
Exogenes (=von aussen kommendes) Histamin
Wichtiger als das körpereigene Histamin ist im Zusammenhang mit der Histamin-Intoleranz das exogene (=von aussen zugeführte) Histamin. Histamin ist ein in den meisten Nahrungsmitteln in unterschiedlichen Konzentrationen vorkommender Bestandteil. Es entsteht als Verderbnisprodukt speziell in vederblichen, fermentierten, gereiften oder lange gelagerten Produkten. Eine weitere, aber weniger wichtige Quelle exogenen Histamins ist die Darmflora. Unter den im Darm lebenden Mikroorganismen befinden sich auch viele Arten, die Histamin bilden können.
Dieses über die Nahrung aufgenommene oder im Darm entstandene Histamin darf nicht in den Körper gelangen, da sonst durch einen zu hohen Histaminspiegel (Vergiftung mit Histamin) die körpereigenen Funktionen von Histamin gestört werden, was zu zahlreichen histaminvermittelten Symptomen führen würde. Beim gesunden Menschen gibt es deshalb zwei wirksame enzymatische Barrieren (siehe "Abbau von Histamin").
Histamin im Tier- und Pflanzenreich
Als kleiner Exkurs sei noch darauf hingewiesen, dass Histamin in einigen Pflanzen und Tieren auch als Abwehrsubstanz produziert und gespeichert wird. Beispielsweise speichert die Grosse Brennnessel in ihren Brennhaaren neben anderen Substanzen Histamin, das bei Berührung abgegeben wird. Die Heuschrecke Poekilocerus bufonius (Pyrgomorphidae) gibt bei Gefahr ein Sekret ab, das neben Cardenoliden ca. 1 % Histamin enthält. Histamin ist auch im Hautdrüsensekret der Südfrösche enthalten. Darüber hinaus können tierische und pflanzliche Abwehrstoffe wie beispielsweise das Mastzelldegranulierende Peptid (MCD-Peptid) des Bienengifts Histamin aus den Mastzellen höherer Tiere freisetzen und somit eine Entzündungsreaktion auslösen.
Funktionen von Histamin
Histamin erfüllt im menschlichen Körper zahlreiche Funktionen als Gewebshormon, Neurotransmitter und Botenstoff (biochemische Signalübertragung), die erst unvollständig erforscht sind. Auf molekularer Ebene vermittelt Histamin seine Funktionen über eine Aktivierung der Histamin-Rezeptoren, von denen man bisher vier verschiedene Sorten entdeckt hat: H1, H2, H3 und H4. Sie gehören zur Familie der G-Protein-gekoppelten Rezeptoren. Histamin entfaltet demnach seine Wirkung, indem es nach dem Schlüssel-Schloss-Prinzip an seine Zielrezeptoren andockt und damit intrazelluläre Signalkaskaden (Signalübertragungsketten) moduliert.
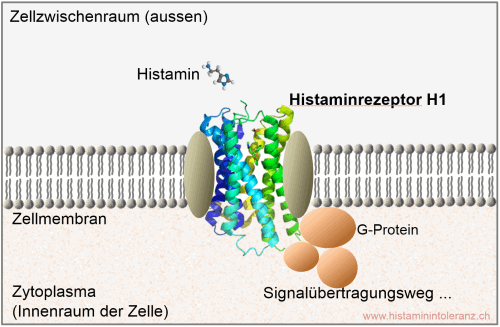
Schematische Zeichnung: Der Histamin-H1-Rezeptor (blau-grüne Spiralstruktur) ist an G-Protein gebunden in die Zellmembran (=äussere Begrenzung der Zelle) eingebaut. Wird der Histaminrezeptor von einem Histamin-Molekül ausserhalb der Zelle aktiviert, löst er im Innern der Zelle ein biochemisches Signal aus. Bildquelle: SIGHI 2012.
Eine Aktivierung von H1-Rezeptoren ist hauptverantwortlich für die beobachteten allergieartigen Wirkungen des Histamins. Dazu zählen Juckreiz und Schmerz, Kontraktion der glatten Muskulatur in Bronchien und grossen Blutgefässen (Durchmesser von mehr als 80 µm) sowie Erweiterung kleinerer Blutgefässe verbunden mit Nesselsucht und Hautrötung [Marshall 1984]. Im Zentralnervensystem ist Histamin über eine Aktivierung von H1-Rezeptoren an der Auslösung des Erbrechens sowie der Regulation des Schlaf-Wach-Rhythmus beteiligt. H1-Rezeptoren sind auch an der Regulation der Ausschüttung von Hormonen, wie z. B. Adrenalin, beteiligt. Histamin ist Mediatorsubstanz bei Entzündungen und Verbrennungen und induziert zudem die vermehrte Freisetzung weiterer Entzündungsmediatoren. Ebenso scheint es an der Regulation der Körpertemperatur, der zentralen Kontrolle des Blutdrucks und der Schmerzempfindung beteiligt zu sein. [Wikipedia: Histamin]
H2-Rezeptoren sind an der Regulation der Magensäureproduktion und der Transportbewegungen des Darms (Motilität, Peristaltik) beteiligt. Die Steigerung der Magensäureproduktion kann dabei als ein Bestandteil einer Histamin-vermittelten Abwehrreaktion interpretiert werden. Ein beschleunigter Weitertransport des Darminhaltes führt zu Durchfall und kann ebenfalls als Abwehreaktion gesehen werden. Eine Stimulation von H2-Rezeptoren führt darüber hinaus zu einer Beschleunigung des Herzschlags, zu einer Steigerung der Schlagkraft des Herzens und zu einer Erweiterung kleiner Blutgefässe.
Im menschlichen Körper ist der H3-Rezeptor insbesondere präsynaptisch auf Nervenzellen des Zentralnervensystems und des peripheren Nervensystems zu finden. Als Autorezeptoren sind sie an einer Drosselung der weiteren Histamin-Ausschüttung durch negative Rückkopplung beteiligt. Über präsynaptische Rezeptoren (insbesondere H3-Rezeptoren) besitzt Histamin durch Hemmung der Neurotransmitterfreisetzung im Zentralnervensystem und im peripheren Nervensystem einen regulatorischen Einfluss auf noradrenerge, serotoninerge, cholinerge, dopaminerge und glutaminerge Neuronen, d.h. es hemmt als Heterorezeptor die Freisetzung der Neurotransmitter Acetylcholin, Noradrenalin und Serotonin. Histamin beeinflusst somit indirekt die Effekte dieser Neurotransmitter. Über diese Mechanismen sind H3-Rezeptoren an der zentralen Regulation des Hunger- und Durstgefühls, des Tag-Nacht-Rhythmus [Rozov et al. 2014], der Körpertemperatur und des Blutdrucks beteiligt. Darüber hinaus soll dieser Rezeptor direkt oder indirekt bei der Pathophysiologie neurologischer Schmerzen, der Schizophrenie, der Parkinson-Krankheit und dem ADHS eine Rolle spielen.
H4-Rezeptoren sind an der zielgerichteten Wanderung von Immunzellen, wie eosinophile Granulozyten, T-Lymphozyten und Monozyten, hin zu Quellen von Histamin beteiligt (Chemotaxis). Daher wird eine wichtige Rolle dieses Rezeptors bei der Rekrutierung von Leukozyten während einer Immunreaktion, insbesondere bei allergischen Reaktionen, angenommen.
Protein-Monoaminylierung steuert zellbiologische Prozesse
Anders als lange angenommen wirken wasserlösliche Hormone wie Serotonin, Histamin und Catecholamine nicht ausschliesslich über Rezeptoren auf der Zelloberfläche, sondern auch durch Monoaminylierung innerhalb von Zellen. Ähnlich wie die Protein-Phosphorylierung hat die Protein-Monoaminylierung (Histaminylierung, Serotonylierung etc.) tiefgreifende Auswirkungen auf vielfältige zellbiologische Prozesse, die noch genauer Aufklärung bedürfen [Vowinckel 2012; Walther, Stahlberg und Vowinckel 2011; Walther 2007; Scinexx 2009]. Mit Antihistaminika - welche ohnehin meist nur für einen einzigen Rezeptortypen spezifisch sind - lassen sich derartige zellbiologische Veränderungen nicht verhindern.
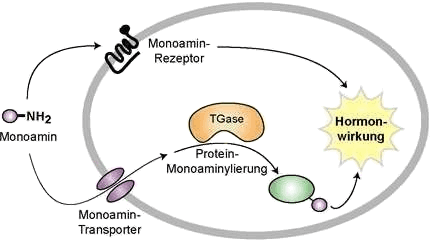
Histamin und andere wasserlösliche Monoamine können die Zellmembran nicht durch Diffusion überwinden. Einen beträchtlichen Teil ihrer Wirkung entfalten sie bekanntlich über zahlreiche, membranständige Monoamin-Rezeptoren (Histaminrezeptoren). Spezifische Monoamin-Transporter reichern Histamin und andere Hormone allerdings auch im Cytoplasma an, wo die Monoamine durch Transglutaminase (TGase)-vermittelte Protein-Monoaminylierung Signalproteine konstitutiv aktivieren. Dadurch kommt es zu länger anhaltenden Hormonwirkungen, wie es von Thrombozyten und Blutgefäss-Muskelzellen bekannt ist. [Walther 2007]
Abbau von Histamin
Histamin kann im menschlichen Stoffwechsel über vier Wege abgebaut (metabolisiert) werden, wobei die beiden erstgenannten die Hauptabbauwege darstellen:
- Oxidative Deaminierung durch die Diaminoxidase (DAO) und in geringerem Masse auch durch die Monoaminoxidase B (MAO-B).
Reaktionsgleichung: Histamin + H2O + O2 => (Imidazol-4-yl)acetaldehyd + NH3 + H2O2 - Ringmethylierung durch die Histamin-N-Methyltransferase (HNMT).
Als Cosubstrat wird ein Methylgruppendonor benötigt. Meist ist dies S-Adenosyl-L-Methionin (SAMe) [Girard et al. 1994].
Das dabei entstehende Abbauprodukt ist N-Methylhistamin. - Acetylierung zum Acetylhistamin.
(Dieser Abbaupfad ist hauptsächlich beim mikrobiellen Abbau von Bedeutung) - Hydroxylierung zur Hydantoinpropionsäure.
(Vitamin C könnte ein Co-Faktor von Hydroxylierungsreaktionen sein, die Histamin in die Hydantoinpropionsäure überführen – analog dem Histidinabbau in Hydantoinpropionat. Vermutlich ist dieser Abbauweg mengenmässig von untergeordneter Bedeutung.)
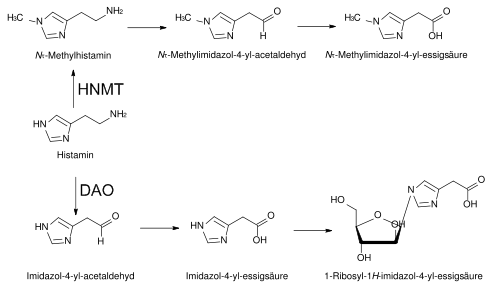
Die beiden Hauptabbauwege von Histamin [Bildquelle: Wikipedia].
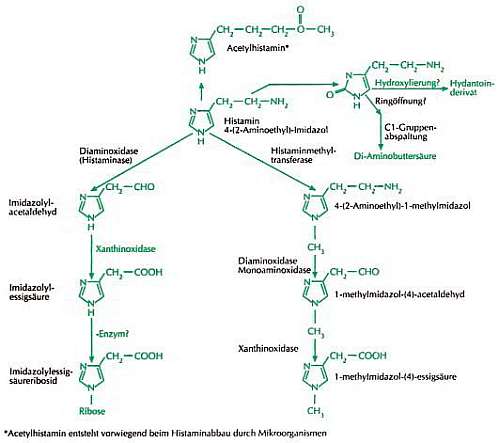
Alle vier bekannten bzw. postulierten Abbauwege von Histamin [Bielenberg 2005].
Etwa 70 % des Histamins wird von der HNMT abgebaut. Der Abbau des übrigen Histamins erfolgt über die DAO. Dieser Anteil variiert aber je nach Organ und Gewebe sehr stark. Je nach Gewebetyp hat mal das eine, mal das andere Enzym die dominierende Rolle im Histaminabbau. [Baenziger et al. 1994]
Die DAO wird als sekretorisches Protein von den Zellen ausgeschieden und ist für den Abbau von Histamin ausserhalb der Zellen (extrazellulär) verantwortlich, wohingegen HNMT als zytosolisches Protein Histamin nur im Innern von Zellen (intrazellulär), beispielsweise in der Leber und im Gehirn, abbaut.
Abbauweg via Diaminoxidase (DAO, ABP1)
![Oberflächenmodell der Diaminoxidase mit den zwei aktiven Zentren. Quelle: [McGrath et al. 2009] Oberflächenmodell der DAO](../pics/dao-full_mcgrath2009.png)
Abbildung: Oberflächenmodell der Diaminoxidase (DAO) mit den zwei aktiven Zentren (=Nischen im 'Proteinknäuel', in denen Histamin enzymatisch deaktiviert werden kann). Bereiche mit negativer Oberflächenladung sind rot dargestellt, Bereiche mit positiver Ladung blau. Quelle: Reprinted (adapted) with permission from [McGrath et al. 2009]. Copyright (2009) American Chemical Society.
Diaminoxidase (DAO) wird nur in bestimmten Organen gebildet. Am meisten DAO findet man in den Darmschleimhautzellen des Dünndarms und des ersten Teils des Dickdarms (Colon ascendens), aber auch in der Plazenta (besonders während der Schwangerschaft), in der Niere und im Thymus [Maintz and Novak 2007]. Von der Darmschleimhaut wird die DAO ins Darmlumen ausgeschieden. Dort, ausserhalb der Zellen, baut sie das Histamin im Nahrungsbrei weitgehend ab, bevor es vom Körper aufgenommen wird. Auf diese Weise bildet die DAO eine erste Barriere gegen das Eindringen von Histamin in den Körper.
Histamin aus der Nahrung, das trotzdem über die Darmschleimhaut in den Körper aufgenommen wird, gelangt in die Blutbahn und wird dort der Leber zugeführt. In der Leber, die allgemein das Entgiftungsorgan des Körpers ist, erfolgt dann der Abbau mittels HNMT.
Abbauweg via Histamin-N-Methyltransferase (HNMT)
Am meisten HNMT wird gebildet im Zentralnervensystem (Hirn) und im Jejunum (=Mittelteil des Dünndarms, zwischen Duodenum und Ileum), aber auch in Lunge, Bronchien, Milz und Magen sowie in Leber und Niere [Kitanaka et al. 2001]. Hauptsächlich in den Bronchien, der Niere und dem Zentralnervensystem ist die Histamin-N-Methyltransferase (HNMT) der Hauptabbauweg zur Deaktivierung von Histamin. Die HNMT ist in gelöster Form im Inneren der Zellen (Zytosol) lokalisiert. Das Histamin zirkuliert jedoch hauptsächlich ausserhalb der Zellen in den Zellzwischenräumen, denn über diesen Botenstoff wollen die Zellen mehr mit anderen Körperzellen kommunizieren als mit sich selber: Das körpereigene Histamin wird aus den Vesikeln nach aussen in die Zellzwischenräume ausgeschüttet und gelangt in diesen Zwischenräumen zu weiter entfernten Zellen. Auch von den Nervenzellen wird Histamin nach aussen in den synaptischen Spalt ausgeschüttet, um ein chemisches Signal an die benachbarte Nervenzelle weiter zu leiten. Ebenso gelangt exogenes Histamin, das aus der Nahrung via Blutversorgung ins Körpergewebe eindringt, über die Zellzwischenräume von aussen an die Zellen heran. Histamin kann jedoch nicht von selbst durch die Zellmembran hindurch ins Zellinnere gelangen. Wie kann nun das ausserhalb der Zellen liegende Histamin von der im Innern der Zelle lokalisierten HNMT abgebaut werden?
Gemäss der Plasmamembran-Hypothese könnte die HNMT auch in die Zellmembran eingebaut sein und und mit einem aus der Zelle herausragenden Teil Histamin ausserhalb der Zelle inaktivieren [Barnes and Hough 2002]. Experimente zeigten, dass die normalerweise in der Zelle in gelöster Form vorliegende HNMT tatsächlich bei Stimulation bestimmter Rezeptoren in die Membran integriert wird, jedoch gibt es widersprüchliche Resultate, ob membrangebundene HNMT am Histaminabbau beteiligt ist oder im Gegenteil sogar an Aktivität einbüsst [Barnes and Hough 2002; Ogasawara et al. 2006].
Gemäss der Transporter-Hypothese gibt es Transportmechanismen, welche das Histamin aktiv in die Zelle hinein transportieren. Die organischen Kationentransporter OCT2 und OCT3 können tatsächlich als Histamintransporter agieren, wie Experimente mit Mäusen zeigten [Ogasawara et al. 2006]. Neuere Untersuchungen bestätigen die Transporter-Hypothese und zeigen, dass bestimmte Monoamintransporter (organic cation transporter 3 (OCT3) und plasma membrane monoamine transporter (PMAT)) beim Histaminabbau via HNMT eine entscheidende Rolle als Zubringer spielen; dies sicher im Zentralnervensystem [Duan and Wang 2010; Dahlin et al. 2007; Yoshikawa et al. 2013] in der Niere [Xia et al. 2006] und in Endothelzellen (=Innenwand von Lymph- und Blutgefässen) [Ferk et al. 2012], aber wahrscheinlich auch in vielen anderen Geweben. Auch für die Regulation des von Basophilen freigesetzten Histamins sind sie wichtig [Daws 2008]. Im Zentralnervensystem pumpen diese Transporter auch andere Neurotransmitter wie z.B. Serotonin ins Innere der Zellen. Werden diese Transportmechanismen genetisch bedingt oder durch äussere Einflüsse gestört, könnte dies auch eine mögliche Ursache für Depressionen oder andere psychische Erkrankungen sein [Lin et al. 2011].
Abbauweg via Monoaminoxidase (MAO)
Die Monoaminoxidase (MAO) befindet sich im Innern der Zellen, eingebunden in die äussere Membran der Mitochondrien [Nair, Ahmed and Kin 1993]. Sie existiert in zwei Formen: MAO-A und MAO-B. Die beiden Moleküle sind 527 und 520 Aminosäuren gross und stimmen in ihrer Aminosäurensequenz nur zu 70% überein. Die MAO-Gene liegen nahe beieinander auf dem X-Chromosom.
Beide Formen bauen Amine ab (durch Deaminierung), aber sie haben ein unterschiedliches Substratspektrum, d.h. nicht beide Formen bauen dieselben Amine gleich gut ab. MAO-A baut bevorzugt Serotonin ab, MAO-B baut bevorzugt ß-Phenylethylamin ab. [Geha et al. 2001]. Welche Aminoxidase welche Amine bevorzugt abbaut, ist jedoch nicht fix, sondern hängt von den Konzentrationen der Amine ab. Bei niedrigen Histaminkonzentrationen wird Histamin nur von der DAO abgebaut, bei hohen Konzentrationen auch (in geringerem Masse) von der MAO-A, jedoch fast gar nicht von der MAO-B. [Ochiai et al. 2006] Im Normalfall spielt folglich die MAO beim Histaminabbau eine unbedeutende Rolle. Bei hohen Histaminkonzentrationen könnte hingegen die MAO-A auch am Histaminabbau beteiligt sein. Erniedrigte MAO-B-Spiegel konnten ebenfalls mit hohen Histaminspiegeln in Verbindung gebracht werden [Kiehl and Ionescu 1989]. Eine funktionsverminderte MAO-B könnte indirekt den Histaminspiegel ansteigen lassen, indem die DAO dann mehr andere biogene Amine abbauen muss. Dadurch bleibt weniger Kapazität für den Histaminabbau übrig.
![Struktur der menschlichen Monoaminoxidase B. Quelle: [Binda 2002] Monoaminoxidase B](../pics/MAO-B_1gos_bio_r_500.jpg)
Abbildung: Struktur der menschlichen Monoaminoxidase B (MAO B). Quelle: [Binda 2002 @ rcsb.org]
Geführter Rundgang: Weiter zur Seite
Histaminose > Ursachen-Überblick
Quellenangaben
Tipp: Der "zurück"-Button Ihres Browsers bringt Sie zur vorherigen Stelle zurück.
| B | Zurück zur vorherigen Stelle |
|---|---|
| Baenziger et al. 1994 | Baenziger NL, Mack P, Jong YJ, Dalemar LR, Perez N, Lindberg C, Wilhelm B, Haddock RC.: "An environmentally regulated receptor for diamine oxidase modulates human endothelial cell/fibroblast histamine degradative uptake". J Biol Chem. 1994 May 27;269(21):14892-8. https://pubmed.ncbi.nlm.nih.gov/8195119 Die DAO ist ein membrangebundenes Enzym, das an DAO-Rezeptoren auf der Zelloberfläche gebunden wird. Die Rezeptordichte kann in Reaktion auf diverse äussere Einflüsse aktiv reguliert werden. |
| Barnes and Hough 2002 | Barnes WG, Hough LB.: "Membrane-bound histamine N-methyltransferase in mouse brain: possible role in the synaptic inactivation of neuronal histamine.". J Neurochem. 2002 Sep;82(5):1262-71. https://pubmed.ncbi.nlm.nih.gov/12358773 (Im Zentralnervensystem ist Histamin ein Neurotransmitter, der durch die HNMT deaktiviert wird. Die HNMT ist ein lösliches Enzym im Zellplasma. Noch ungeklärt ist, wie das Histamin, das von den Nervenzellen nach aussen in den synaptischen Spalt ausgeschüttet wird, von der im Zellinneren lokalisierten HNMT deaktiviert werden kann. Die (nur in sehr geringem Ausmass stattfindende) Aufnahme von Histamin in die Nervenzelle kann dabei nur eine untergeordnete Rolle spielen. Hingegen konnte gezeigt werden, dass die Membranfraktion der Zellen am Histaminabbau beteiligt sein muss. Man vermutet, dass es eine membranständige HNMT gibt. Deren Existenz konnte noch nicht nachgewiesen werden, doch es muss irgend einen Histamin-Abbaumechanismus ausserhalb der Zelle geben. [Anmerkung: Die DAO kann es nicht sein, da sie im Nervensystem nicht gebildet wird.]) |
| Binda 2002 @ rcsb.org | Image from the RCSB PDB (www.rcsb.org) of PDB ID 1GOS.Binda C, Newton-Vinson P, Hubálek F, Edmondson DE, Mattevi A.: "Structure of human monoamine oxidase B, a drug target for the treatment of neurological disorders.". Nat Struct Biol. 2002 Jan;9(1):22-6. http://www.rcsb.org/pdb/explore.do?structureId=1gos https://pubmed.ncbi.nlm.nih.gov/11753429 (Struktur der menschlichen Monoaminoxidase B (MAO B)) |
| Bielenberg 2005 | Bielenberg, Jens: "Korrelate einer schadstoffinduzierten Veränderung des Histaminstoffwechsels? Die Allergie-Hypothese". Österreichische Apotheker-Zeitung ÖAZ Aktuell (Ausgabe 15/2005), Hauptartikel 15/2005. Anschrift des Autors: Apotheker Jens Bielenberg, Raphael-Apotheke, D-25364 Westerhorn, Bahnhofstr. 53 Der Artikel ist inzwischen online nicht mehr auffindbar. Ein sehr ähnlicher Text desselben Autors ist hier abrufbar: Bielenberg, Jens: "Die Allergie-Hypothese – Fakt oder Fiktion? Allergien - Korrelate einer schadstoffinduzierten Veränderung des Histaminstoffwechsels?". Ärztezeitschrift für Naturheilverfahren 46, 11 (2005).https://www.yumpu.com/de/document/view/6248824/die-allergie-hypothese-fakt-oder-fiktion-zentralverband-der- (Interessanter Artikel über mögliche Ursachen von Allergien, Störfaktoren im Histaminstoffwechsel, Abbaumechanismen von Histamin, Ascorbate (Vitamin C), Umweltschadstoffe, Schilddrüsenerkrankungen) |
| D | Zurück zur vorherigen Stelle |
| Dahlin et al. 2007 | A. Dahlin, L. Xia, W. Kong, R. Hevner, and J. Wang: "Expression and Immunolocalization of the Plasma Membrane Monoamine Transporter in the Brain". Neuroscience. 2007 May 25; 146(3): 1193–1211. Published online 2007 April 3. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2683847/ |
| Daws 2008 | Lynette C. Daws: "Unfaithful neurotransmitter transporters: Focus on serotonin uptake and implications for antidepressant efficacy". Pharmacol Ther. 2009 January; 121(1): 89–99. Published online 2008 October 29. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2739988/ |
| Duan and Wang 2010 | Haichuan Duan and Joanne Wang: "Selective Transport of Monoamine Neurotransmitters by Human Plasma Membrane Monoamine Transporter and Organic Cation Transporter 3". J Pharmacol Exp Ther. 2010 December; 335(3): 743–753. doi: 10.1124/jpet.110.170142 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2993547/ |
| F | Zurück zur vorherigen Stelle |
| Ferk et al. 2012 | Polonca Ferk, Metoda Lipnik-Štangelj, Mojca Kržan, and Katarina Cerne: "Expression of organic cation transporter 3 (SLC22A3) and plasma membrane monoamine transporter (SLC29A4) in human umbilical vein endothelial cells and their relevance for histamine uptake". BMC Pharmacol Toxicol. 2012; 13(Suppl 1): A73. Published online 2012 September 17. doi: 10.1186/2050-6511-13-S1-A73 http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3506340/ |
| G | Zurück zur vorherigen Stelle |
| Girard et al. 1994 | Girard B, Otterness DM, Wood TC, Honchel R, Wieben ED, Weinshilboum RM.: "Human histamine N-methyltransferase pharmacogenetics: cloning and expression of kidney cDNA". Mol Pharmacol. 1994 Mar;45(3):461-8. https://pubmed.ncbi.nlm.nih.gov/8145732 |
| Geha et al. 2001 | Geha RM, Rebrin I, Chen K, Shih JC: "Substrate and inhibitor specificities for human monoamine oxidase A and B are influenced by a single amino acid". J Biol Chem. 2001 Mar 30;276(13):9877-82. Epub 2000 Dec 29. http://www.jbc.org/content/276/13/9877.long |
| H | Zurück zur vorherigen Stelle |
| Hough 1999 | Hough, Lindsay B.: "Histamine". American Society for Neurochemistry, 1999. http://www.ncbi.nlm.nih.gov/books/NBK20394/ (Über die Rolle von Histamin im Nervensystem. Zusammenfassende Übersetzung hier) |
| J | Zurück zur vorherigen Stelle |
| Jarisch 2004 | Jarisch, Reinhart: "Histamin-Intoleranz, Histamin-Intoleranz und Seekrankheit", Thieme-Verlag, 2. Auflage, 2004. ISBN 3-13-105382-8 |
| K | Zurück zur vorherigen Stelle |
| Kiehl und Ionescu 1989 | Kiehl R, Ionescu G.: "[Histamine degrading enzymes in atopic eczema]. Histamin abbauende Enzyme bei atopischem Ekzem." Z Hautkr. 1989 Dec 15;64(12):1121-3. https://pubmed.ncbi.nlm.nih.gov/2517372 (Increased plasma histamine levels were associated with significantly lowered diamine and type B monoamine oxidase activities in platelet rich plasma of atopic eczema (AE) patients. The diamine oxidase has almost normal cofactor levels (pyridoxal phosphate and Cu2+) but the cofactor levels for type B monoamine oxidase (flavin adenine dinucleotide and Fe2+) are lowered.) |
| Kitanaka et al. 2001 | Kitanaka J, Kitanaka N, Tsujimura T, Kakihana M, Terada N, Takemura M.: "Guinea pig histamine N-methyltransferase: cDNA cloning and mRNA distribution." Jpn J Pharmacol. 2001 Jan;85(1):105-8. https://www.ncbi.nlm.nih.gov/pubmed/11243563 (Verteilung der HNMT im Körper.) |
| L | Zurück zur vorherigen Stelle |
| Lin et al. 2011 | Zhicheng Lin, Juan J. Canales, Thröstur Björgvinsson, Morgane M. Thomsen, Hong Qu, Qing-Rong Liu, Gonzalo E. Torres, and S. Barak Caine: "Monoamine Transporters: Vulnerable and Vital Doorkeepers". Prog Mol Biol Transl Sci. 2011; 98: 1–46. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3321928/ |
| M | Zurück zur vorherigen Stelle |
| Maintz et al. 2006 | Maintz, Laura; Bieber, Thomas; Novak, Natalija: "Die verschiedenen Gesichter der Histaminintoleranz: Konsequenzen für die Praxis (Histamine Intolerance in Clinical Practice)", Deutsches Ärzteblatt 2006; 103(51-52). http://www.aerzteblatt.de/archiv/53958, abgerufen am 25.08.2009. |
| Maintz and Novak 2007 | Maintz L, Novak N.: "Histamine and histamine intolerance.", Am J Clin Nutr. 2007 May;85(5):1185-96. Department of Dermatology, University of Bonn, Bonn, Germany. https://pubmed.ncbi.nlm.nih.gov/17490952) |
| Mannaioni et al. 1993 | P. F. Mannaioni, M. G. Di Bello, S. Raspanti, F. Gambassi, L. Mugnai and E. Masini: "Histamine Release from Mast Cells and Basophils. Histamine release by human platelets." Inflammation Research, Volume 38, Numbers 3-4 (1993), C203-C205, DOI: 10.1007/BF01996460. http://www.springerlink.com/content/x0063474j4685x12/) |
| Marshall 1984 | Marshall I.: "Characterization and distribution of histamine H1- and H2-receptors in precapillary vessels." J Cardiovasc Pharmacol. 1984;6 Suppl 4:S587-97. https://www.ncbi.nlm.nih.gov/pubmed/6083401 (Blutgefässe und Histaminrezeptoren.) |
| Masini et al. 1994 | Masini E, Di Bello MG, Raspanti S, Sacchi TB, Maggi E, Mannaioni PF.: "Platelet aggregation and histamine release by immunological stimuli.", Immunopharmacology. 1994 Jul-Aug;28(1):19-29. http://www.ncbi.nlm.nih.gov/pubmed/7523332) |
| McGrath et al. 2009 | McGrath AP, Hilmer KM, Collyer CA, Shepard EM, Elmore BO, Brown DE, Dooley DM, Guss JM.: "Structure and inhibition of human diamine oxidase". Biochemistry. 2009 Oct 20;48(41):9810-22. http://www.ncbi.nlm.nih.gov/pubmed/19764817 (Struktur und Hemmstoffe der DAO.) |
| N | Zurück zur vorherigen Stelle |
| Nair, Ahmed and Kin 1993 | Nair NP, Ahmed SK, Kin NM.: "Biochemistry and pharmacology of reversible inhibitors of MAO-A agents: focus on moclobemide." J Psychiatry Neurosci. 1993 Nov;18(5):214-25. https://www.ncbi.nlm.nih.gov/pubmed/7905288 ("The enzymes are usually present on the outer mitochondrial membrane of both neuronal and non-neuronal cells (Greenwalt 1972). Most human tissues contain both types of MAO. In the periphery, MAO-A is found mostly in the sympathetic terminals, intestinal mucosa and placenta, whereas MAO-B predominates in the liver, lungs and blood platelets (Da Prada et al 1988; Youdim et al 1980).") |
| O | Zurück zur vorherigen Stelle |
| Ochiai et al. 2006 | Ochiai Y, Itoh K, Sakurai E, Adachi M, Tanaka Y.: "Substrate selectivity of monoamine oxidase A, monoamine oxidase B, diamine oxidase, and semicarbazide-sensitive amine oxidase in COS-1 expression systems." Biol Pharm Bull. 2006 Dec;29(12):2362-6. https://pubmed.ncbi.nlm.nih.gov/17142964 (Welches Enzym baut welche Amine ab?) |
| Ogasawara et al. 2006 | Ogasawara M, Yamauchi K, Satoh Y, Yamaji R, Inui K, Jonker JW, Schinkel AH, Maeyama K.: "Recent advances in molecular pharmacology of the histamine systems: organic cation transporters as a histamine transporter and histamine metabolism.". J Pharmacol Sci. 2006 May;101(1):24-30. Epub 2006 Apr 28. https://pubmed.ncbi.nlm.nih.gov/16648665 (Die HNMT ist im Inneren der Zellen lokalisiert und deaktiviert Histamin hauptsächlich in Bronchien, Niere und dem Zentralnervensystem. Histamin kann nicht von selbst durch die Zellmembran hindurch ins Zellinnere gelangen. Man vermutete, dass die HNMT trotzdem am Abbau von Histamin, das von ausserhalb kommt, beteiligt sein kann. Dies entweder indem die HNMT auch in die Zellmembran eingebaut sein könnte und auf diese Weise Histamin ausserhalb der Zelle inaktivieren kann, oder indem Transportmechanismen das Histamin aktiv in die Zelle hinein transportieren. Die organischen Kationentransporter OCT2 und OCT3 könnten tatsächlich als Histamintransporter agieren, wie Experimente mit Mäusen zeigten. Die höhere Sterblichkeit der Mäuse mit ausgeschaltetem OCT3 erklärt man sich so, dass der dadurch erhöhte Histaminspiegel die Histaminrezeptoren der Mastzellen, Makrophagen und dendritischen Zellen stimuliert und dadurch die Funktion der Immunzellen verändert haben könnte.) |
| P | Zurück zur vorherigen Stelle |
| Potera 2012 | Carol Potera: "Common bacterium induces histamine production in neutrophils". Environ Health Perspect. 2012 May;120(5):A190. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3346795/pdf/ehp.120-a190.pdf (Neutrophile Granulozyten (weisse Blutkörperchen) gehören ebenfalls zu den Histamin produzierenden Zelltypen und erhöhen die Histaminproduktion um ein Mehrfaches bei Kontakt mit bestimmten Bakterienarten.) |
| R | Zurück zur vorherigen Stelle |
| Rozov et al. 2014 | Rozov SV, Zant JC, Karlstedt K, Porkka-Heiskanen T, Panula P.: "Periodic properties of the histaminergic system of the mouse brain." Eur J Neurosci. 2014 Jan;39(2):218-28. doi: 10.1111/ejn.12397. Epub 2013 Nov 6. https://pubmed.ncbi.nlm.nih.gov/24438489 |
| S | Zurück zur vorherigen Stelle |
| Scinexx 2009 | "Glückshormon reguliert auch Zuckerstoffwechsel. Wirkmechanismus von Serotonin in der Bauchspeicheldrüse aufgeklärt.", Wissensmagazin www.scinexx.de, Springer Verlag. www.scinexx.de/wissen-aktuell-10727-2009-10-29.html, abgerufen am 29.10.2009. Siehe auch folgende Primärliteratur: Paulmann, N. et al.: "Intracellular serotonin modulates insulin secretion from pancreatic ß-cells by protein serotonylation.", PLoS Biol., 7 (2009) e1000229. doi:10.1371/journal.pbio.1000229. Walther, D.J. et al.: "Serotonylation of Small GTPases is a Signal Transduction Pathway that Triggers Platelet alpha-Granule Release", Cell, 115 (2003) 851-862. |
| V | Zurück zur vorherigen Stelle |
| Vowinckel 2012 | Vowinckel, Jakob: "Die Protein-Monoaminylierung als regulatorischer Mechanismus in der Signaltransduktion; [Protein-monoaminylation - a novel regulatory mechanism in signal transduction]", Dissertation, Freie Universität Berlin. http://www.diss.fu-berlin.de/diss/receive/FUDISS_thesis_000000023285. |
| W | Zurück zur vorherigen Stelle |
| Walther, Stahlberg und Vowinckel 2011 | Walther DJ, Stahlberg S, Vowinckel J.: "Novel roles for biogenic monoamines: from monoamines in transglutaminase-mediated post-translational protein modification to monoaminylation deregulation diseases.", FEBS J. 2011 Dec;278(24):4740-55. doi: 10.1111/j.1742-4658.2011.08347.x. Epub 2011 Nov 21. https://pubmed.ncbi.nlm.nih.gov/21923757 |
| Walther 2007 | Walther, D.J.: "Protein-Monoaminylierung: Neu erkannte Funktionen monoaminerger Hormone", Jahrbuch 2007, Max-Planck-Institut für molekulare Genetik. www.mpg.de/463476/forschungsSchwerpunkt1 |
| Wikipedia: Histamin | Wikipedia-Artikel: Histamin. de.wikipedia.org/wiki/Histamin, abgerufen am 25.08.2009 |
| X | Zurück zur vorherigen Stelle |
| Xia et al. 2006 | Li Xia, Karen Engel, Mingyan Zhou, and Joanne Wang: "Membrane localization and pH-dependent transport of a newly cloned organic cation transporter (PMAT) in kidney cells". Am J Physiol Renal Physiol. 2007 February; 292(2): F682–F690. Published online 2006 October 3. doi: 10.1152/ajprenal.00302.2006. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2672957/ |
| Xu et al. 2012 | Xu X, Zhang H, Song Y, Lynch SV, Lowell CA, Wiener-Kronish JP, Caughey GH.: "Strain-dependent induction of neutrophil histamine production and cell death by Pseudomonas aeruginosa.". J Leukoc Biol. 2012 Feb;91(2):275-84. Epub 2011 Nov 10. https://pubmed.ncbi.nlm.nih.gov/22075928 (Neutrophile Granulozyten (weisse Blutkörperchen) gehören ebenfalls zu den Histamin produzierenden Zelltypen und erhöhen die Histaminproduktion um ein Mehrfaches bei Kontakt mit bestimmten Bakterienarten.) |
| Y | Zurück zur vorherigen Stelle |
| Yoshikawa et al. 2013 | Yoshikawa T, Naganuma F, Iida T, Nakamura T, Harada R, Mohsen AS, Kasajima A, Sasano H, Yanai K.: "Molecular mechanism of histamine clearance by primary human astrocytes". Glia. 2013 Jun;61(6):905-16. doi: 10.1002/glia.22484. Epub 2013 Mar 15. https://pubmed.ncbi.nlm.nih.gov/23505051 |
![[SIGHI]](../pics/logo_sighi_160x160_terracotta.png)
![Schematischer Vergleich von Allergie und Pseudoallergie. [Quelle: Wikipedia. Urheber: Dr. Jürgen Groth] [Allergie versus Pseudoallergie]](../pics/allergie-pseudoallergie.png)